Isotopes : ce qu’il faut retenir

L’isotope est un atome dont les propriétés lui accordent une place stratégique dans de nombreux domaines comme la santé, l’industrie ou encore la recherche fondamentale. Partons à la découverte de ces étranges « matières » au cœur de l’innovation technologique…
Qu’est-ce qu’un isotope ?
La matière qui nous entoure, l’eau, l’air, ou encore, les êtres vivants, est constituée d’éléments invisibles à l’œil nu, les atomes. Ces atomes sont composés d’un noyau,
autour duquel gravitent des électrons.
A l’intérieur du noyau de l’atome se trouvent des particules appelées neutrons, qui sont liés à des protons. On nomme l’ensemble de ces protons
et neutrons, les nucléons, qui déterminent par leur nombre la masse atomique de l’atome.
Quand on parle d’isotope, on distingue un type d’atome qui possède le même nombre de protons et
un nombre différent de neutrons.
Les propriétés des isotopes
A l’intérieur du noyau atomique, le nombre de protons définit les propriétés chimiques de l’atome. Deux atomes possédant un nombre identique de protons sont appelés des isotopes. Ils
appartiennent au même élément chimique par leur nombre de protons dans le noyau.
Cependant, les isotopes, qui appartiennent au même élément chimique, se distinguent par des propriétés
physiques différentes dues à leur nombre de neutrons. Le neutron est une particule élémentaire de charge électrique neutre, qui peut être stable ou instable.
Chaque isotope du même
élément chimique partage ainsi le même numéro atomique (Z), qui correspond à leur nombre de protons.
Ils se distinguent cependant par leur numéro de masse atomique (neutrons + protons) ; leur nombre de neutrons étant différent.
L’exemple des isotopes de carbone
Prenons l’exemple des isotopes carbone 12 et carbone 14. Tous deux sont des isotopes du même élément chimique, le carbone. Ces isotopes possèdent chacun 6 protons. Cependant, leur nombre
de neutrons change.
Le carbone 12 possède 6 neutrons et le carbone 14 a 8 neutrons. Par leur nombre de neutrons, ils ont des propriétés physiques différentes.
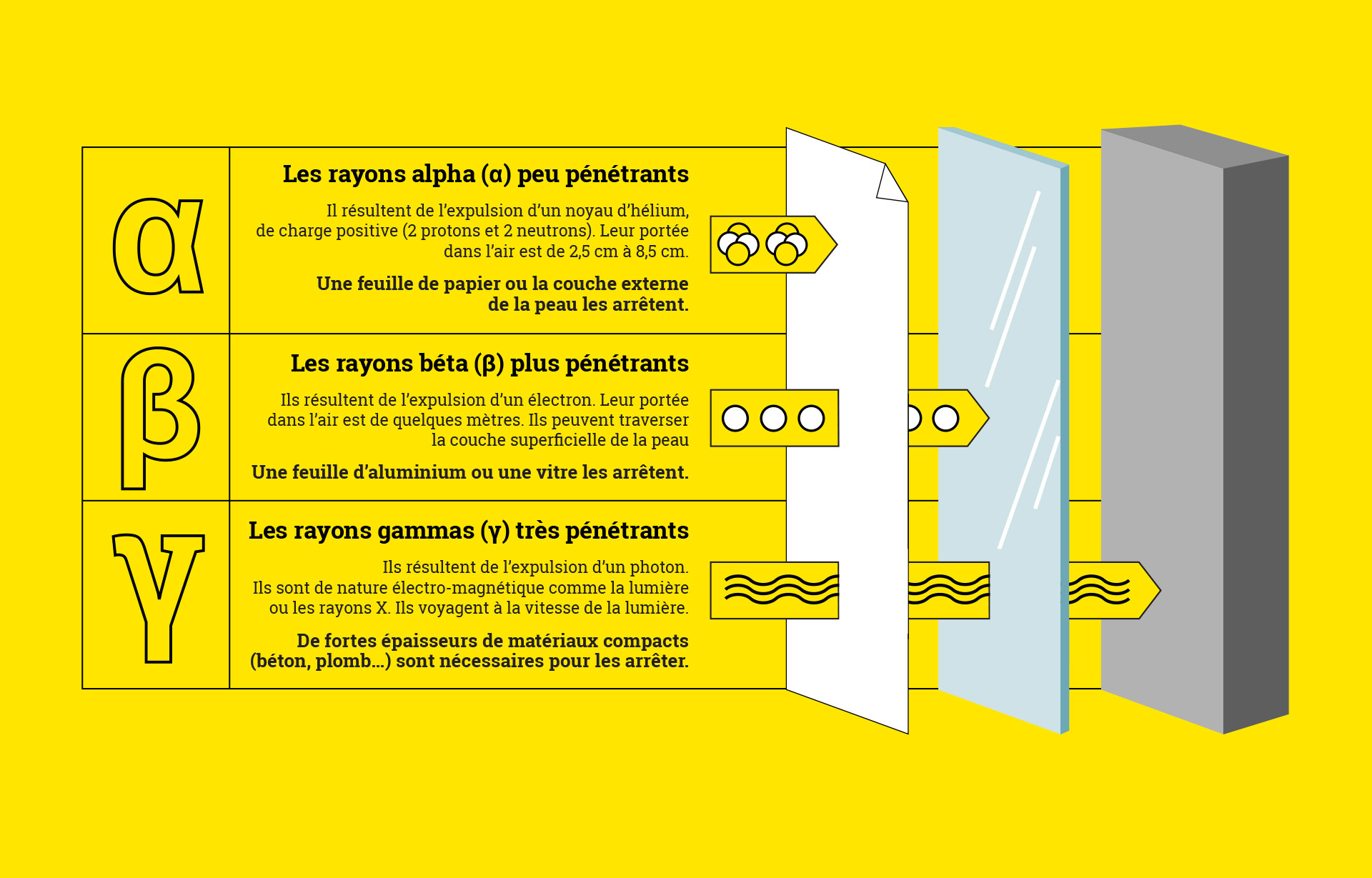
Le carbone 14 est considéré comme
un isotope instable. Il se désintègre et émet de la radioactivité avec des rayons bêta. Il possède en tout 14 nucléons (soit 6 protons et 8 neutrons).
Dans la
notation du carbone 14, on écrit donc 14
6
C, C étant le symbole chimique du carbone, 14 son nombre de masse atomique (protons + neutrons) et 6 correspond à son numéro atomique, soit son nombre de protons.

Le saviez-vous ?
Le carbone 14 est un isotope utilisé pour la datation des objets et matières vivantes en archéologie.
Quels sont les différents types d’isotopes ?
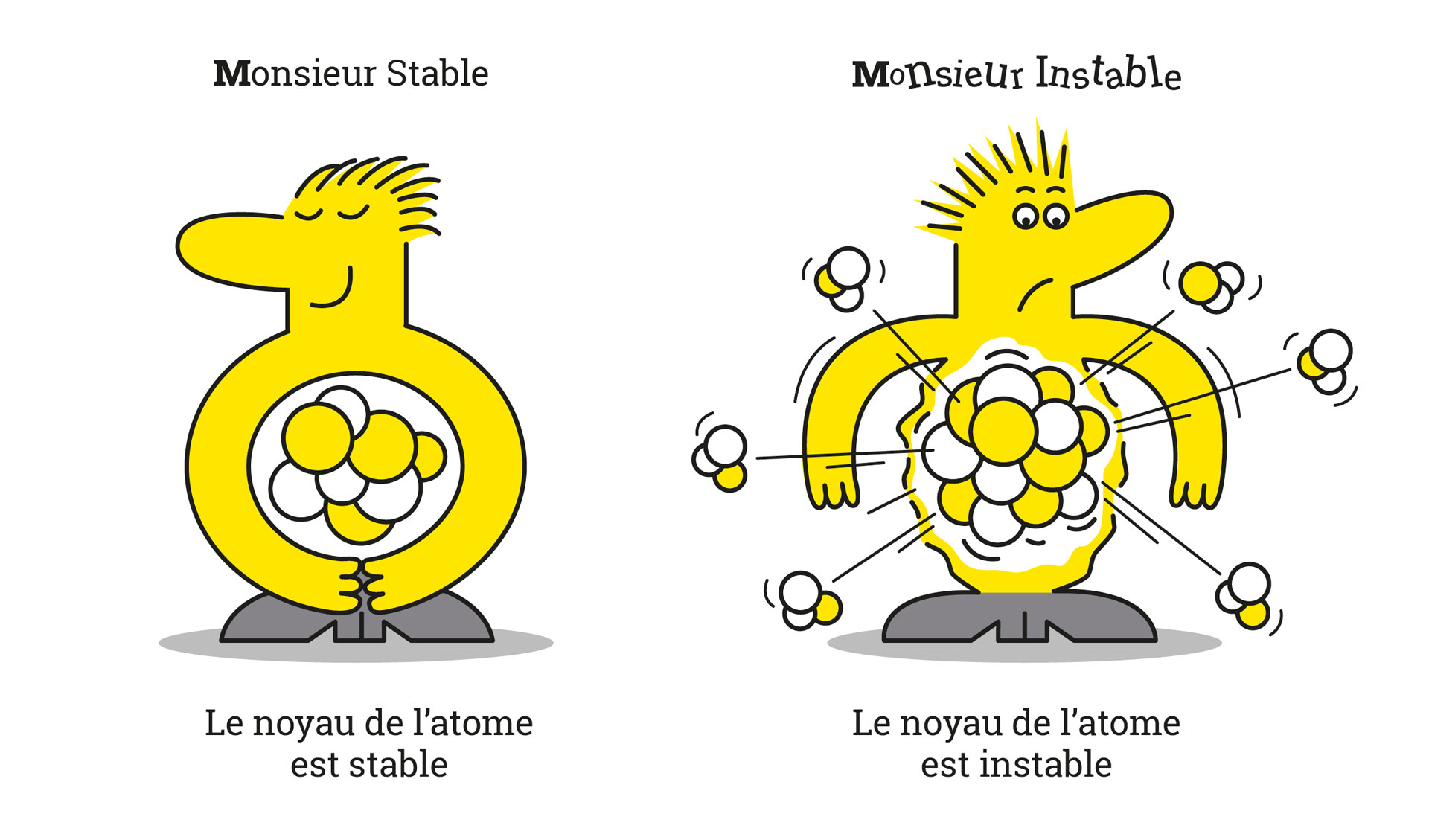
En science, les isotopes se divisent en deux catégories : les isotopes dits instables ou radioactifs, et les isotopes stables. Ces derniers ne changent pas et n’émettent pas de rayonnement radioactif.
Cependant, certains isotopes, comme le Xénon, sont réputés stables, alors que le Xénon 124 et Xénon 136 se dégradent en plusieurs trilliards d’année. Ces derniers sont ainsi considérés
comme stables à l’échelle d’une vie humaine.
Quant aux isotopes instables, ils contiennent un surplus d’énergie qu’ils diffusent sous la forme de rayonnements. On parle de radioactivité.
Les isotopes stables
Les isotopes stables se définissent par une association entre protons et neutrons, qui ne produit aucune radioactivité. C’est la quantité de neutrons dans le noyau de l’atome qui garantit cette stabilité.
Reprenons le cas du carbone 12 qui est stable. Il possède 6 protons et 6 neutrons. Quant au carbone 14, il possède 6 neutrons et 8 neutrons, ce qui crée son instabilité.
Quelques exemples d’isotopes
stables : les isotopes de l’oxygène, de l’hydrogène, ou encore, de l’azote. L’hydrogène a 3 isotopes : H, 2H et 3H. Ils ont chacun 1 proton
et un nombre différent de neutrons.
Les isotopes stables sont principalement utilisés en science, par exemple, pour l’étude de la composition chimique des minéraux. Le recours aux isotopes
stables aide les scientifiques dans l’étude de la provenance des pierres, ou encore, des métaux. C’est le cas du carbone 12.
Les isotopes stables sont très prometteurs dans différentes
applications : médecine, industrie, recherche fondamentale et informatique quantique… Ils sont au cœur de l’innovation technologique.
-
Découvrez notre activité au sein du Laboratoire Isotopes StablesEn savoir plus
Les isotopes instables
Les isotopes de l’uranium : 234, 235 et 238, font partie des isotopes naturels les plus abondants et les plus stables.
Les isotopes de l’uranium : 232 et 236, par exemple, sont produits dans des réacteurs à fission. Avec l’uranium 233, ils font partis des isotopes produits artificiellement.
Pour le combustible nucléaire, c’est justement cette instabilité des isotopes qui est sollicitée. Elle contribue à générer notamment des réactions de fission nucléaire. Les isotopes instables de l’uranium sont ainsi utilisés comme combustible pour les centrales nucléaires.
Le saviez-vous ?
L’équipe de baseball dans la série animée Les Simpson se nomme « Les Isotopes ». Clin d’œil à leur sponsor, la centrale nucléaire de Springfield.
La naissance du tableau périodique de Mendeleïev
On distingue plusieurs familles d’isotopes, soit d’éléments chimiques. Pour les classer, le chimiste Dmitri Mendeleïev les a regroupés au 19e siècle dans le tableau de classification des éléments
chimiques. Ces derniers sont rangés par famille d’éléments et selon leur masse atomique croissante.
Au démarrage, seulement une 30e d’éléments chimiques sont répertoriés,
contre plus de 80 à la fin du 19e siècle.
Le tableau comporte aujourd’hui 118 éléments, incluant environ 325 isotopes naturels et 1200 isotopes fabriqués artificiellement.
Ce
tableau a pour but d’identifier plus facilement les différents composés chimiques par type d’atomes.
-
Le tableau périodique des élémentsEn savoir plus
A quoi servent les isotopes ?
L’utilisation des isotopes instables, appelés également radioactifs ou radio-isotopes, a permis des avancées majeures dans les secteurs de l’industrie, de l’archéologie avec la datation au carbone 14, mais
aussi dans les traitements contre le cancer.
Les isotopes et la production de l’énergie
 L’énergie nucléaire, telle que nous la connaissons, a été rendue possible par l’intervention humaine. Deux procédés
industriels ont été mis en place, la fusion et la fission nucléaire.
L’énergie nucléaire, telle que nous la connaissons, a été rendue possible par l’intervention humaine. Deux procédés
industriels ont été mis en place, la fusion et la fission nucléaire.
Dans le cas de la fusion, il s’agit de combiner deux noyaux d’atomes pour former un plus grand atome et produire
ainsi plus d’énergie.
Pour ce qui est de la fission nucléaire, le processus consiste à désintégrer ou diviser un noyau en plus petits noyaux atomiques. En fission, on utilise l’isotope Pu-239 du plutonium, ainsi que l’isotope
U-235 de l’uranium. Quand les noyaux des isotopes se divisent, ils favorisent une production élevée d’énergie.
Le saviez-vous ?
Des isotopes stables comme le zinc, appauvri en zinc 64, contribue à la réduction de la corrosion des équipements de refroidissement des réacteurs nucléaires, tout en limitant la production de déchets radioactifs.
Les isotopes instables et le traitement contre le cancer
 Dans l’évolution des traitements contre le cancer, l’utilisation des isotopes joue un rôle majeur, notamment en oncologie.
Dans l’évolution des traitements contre le cancer, l’utilisation des isotopes joue un rôle majeur, notamment en oncologie.
Comme exemple de traitement innovant, on retrouve l’utilisation d’un atome radioactif, le plomb-212. Ce dernier est associé à des molécules biologiques, comme des anticorps. En se désintégrant,
l’isotope plomb-212 émet des rayonnements alphas entraînant l’élimination de cellules cancéreuses. Les dommages sur les cellules saines environnantes sont ainsi limités.
Il s’agit
d’un procédé unique appelé alphathérapie ciblée, développé notamment
par Orano Med, la filiale médicale d’Orano, qui avait lancé son 1er essai clinique en 2012.
Les radio-isotopes pour l’imagerie médicale et les traitements médicaux
 Les radio-isotopes font désormais partie intégrante de nombreuses procédures dans
le diagnostic médical. On retrouve leur utilisation dans la détection anticipée de tumeurs, ou encore, la scintigraphie.
Les radio-isotopes font désormais partie intégrante de nombreuses procédures dans
le diagnostic médical. On retrouve leur utilisation dans la détection anticipée de tumeurs, ou encore, la scintigraphie.
Avec la scintigraphie radio-isotopique, les isotopes radioactifs sont sollicités
dans la production des images. Par exemple, à l’aide des rayons gamma équivalents à des rayons X, leur rayonnement favorise la prise d’images de la zone ciblée lors de l’examen.
De
nombreux radio-isotopes médicaux actuellement utilisés par près de 35 millions de patients, sont ou peuvent être produits à partir d’isotopes stables irradiés.
80% des procédures
de médecine nucléaire font appel à des radio-médicaments, qui améliorent la réalisation de diagnostic comme la scintigraphie pulmonaire.
Les isotopes instables et l’archéologie
 En plus de la datation des œuvres d’art avec l’utilisation de l’isotope carbone 14, l’analyse isotopique permet l'identification
des contrefaçons, notamment par l’étude de la datation de l’œuvre.
En plus de la datation des œuvres d’art avec l’utilisation de l’isotope carbone 14, l’analyse isotopique permet l'identification
des contrefaçons, notamment par l’étude de la datation de l’œuvre.
Les isotopes sont aussi utilisés pour la préservation des œuvres par application d’un rayonnement gamma.
Son objectif consiste à ralentir la détérioration de l’œuvre.
L’utilisation des isotopes en informatique quantique
 Le recours au silicium-28 promet de grandes avancées dans l’industrialisation des puces quantiques à des milliers, voire à des millions
de « qubits ». Pour ce faire, les chercheurs ont besoin de silicium enrichi en isotope 28. Le silicium naturel est composé de 92 % de l’isotope 28, après transformation, il sera augmenté à plus de 99,9
%.
Le recours au silicium-28 promet de grandes avancées dans l’industrialisation des puces quantiques à des milliers, voire à des millions
de « qubits ». Pour ce faire, les chercheurs ont besoin de silicium enrichi en isotope 28. Le silicium naturel est composé de 92 % de l’isotope 28, après transformation, il sera augmenté à plus de 99,9
%.
Les isotopes stables et la recherche fondamentale
 Les isotopes stables servent un grand nombre de secteur d’avenir comme l’informatique quantique et des expériences fondamentales pour améliorer
la compréhension de la matière. Par exemple, l’isotope 136 du Xénon (8,9 % à l’état naturel) permet d’effectuer des recherches sur la matière.
Les isotopes stables servent un grand nombre de secteur d’avenir comme l’informatique quantique et des expériences fondamentales pour améliorer
la compréhension de la matière. Par exemple, l’isotope 136 du Xénon (8,9 % à l’état naturel) permet d’effectuer des recherches sur la matière.
Les isotopes stratégiques du nucléaire
Au cœur de la filière nucléaire, certains isotopes jouent un rôle clé dans la production d’énergie, la recherche scientifique et le développement de solutions innovantes.
Chez Orano, ces isotopes dits « stratégiques » sont au centre de nombreuses expertises du groupe : du cycle du combustible à la valorisation des matières, en passant par la recherche et la médecine nucléaire.
👉 On vous en dit plus dans les fiches ci-dessous !